
In three dimensional structure along with alpha helix, beta sheet, beta turns and other non co
Those with branches at the beta carbon (Val, Ile) destabilize the alpha helix due to steric interactions of the bulky side chains with the helix backbone. (Remember left-handed alpha helices are not found in nature for similar reasons.) alpha keratins, the major component of hair, skin, fur, beaks, and fingernails, are almost all alpha helix.

Sekundärstruktur • einfach erklärt, αHelix und βFaltblatt · [mit Video]
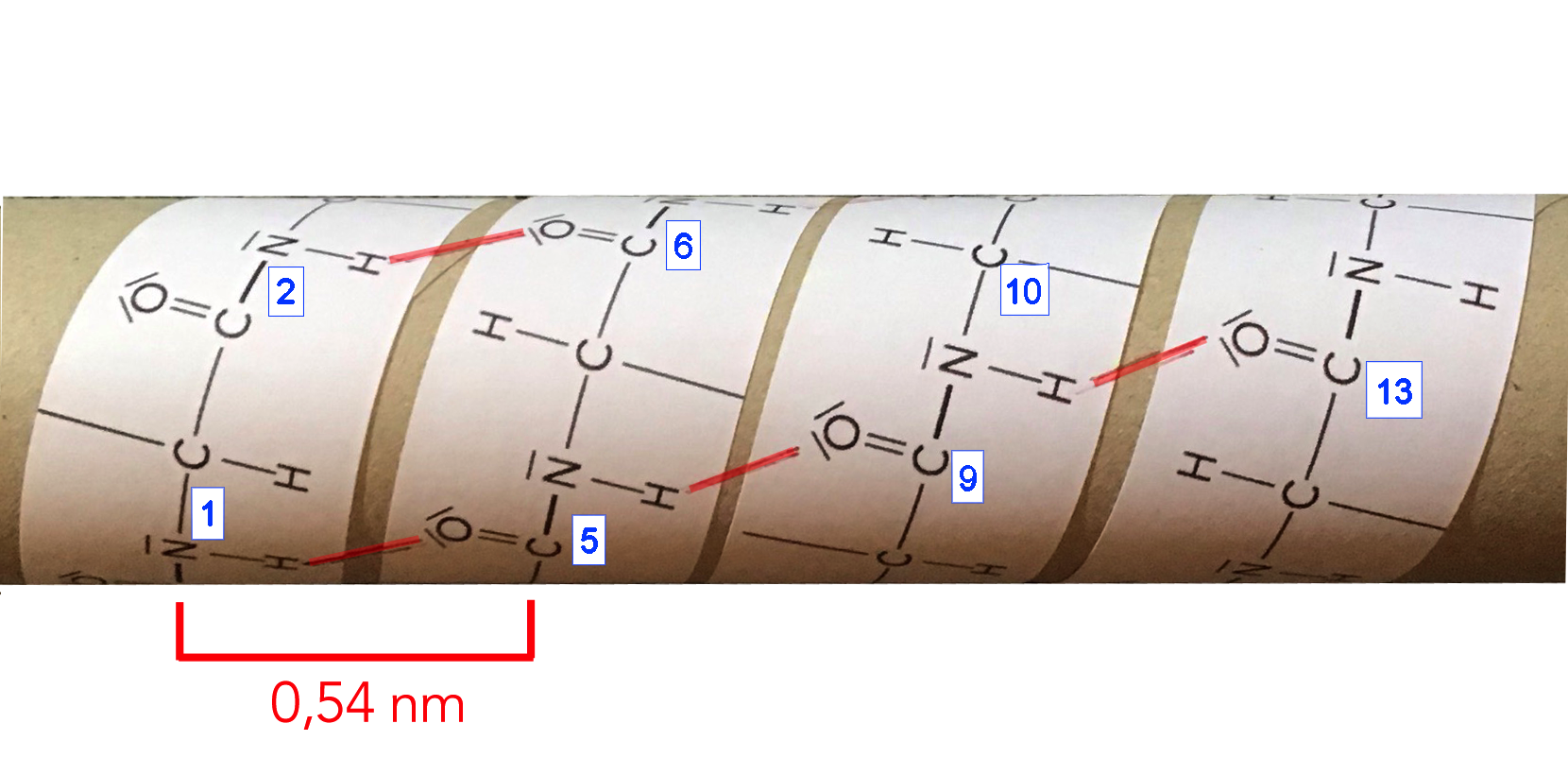
Alpha-Helix ist eine Rechtshänder- oder Spiralkonformation von Polypeptidketten. In der Alpha-Helix gibt jede N-H-Gerüstgruppe eine Wasserstoffbrücke an die C = O-Gerüstgruppe ab, die zuvor in vier Resten angeordnet ist. Hier treten Wasserstoffbrücken innerhalb einer Polypeptidkette auf, um eine helikale Struktur zu erzeugen.
Sekundärstrukturen
Abstract. PNAS papers by Linus Pauling, Robert Corey, and Herman Branson in the spring of 1951 proposed the α-helix and the β-sheet, now known to form the backbones of tens of thousands of proteins. They deduced these fundamental building blocks from properties of small molecules, known both from crystal structures and from Pauling's.
WSR012 Scientists4Future, Ordnungsebenen von Proteinen und Synchrotronstrahlung Wirkstoffradio
A helix is a curve on a cylinder surface such that the angle between the curve and a plane perpendicular to the axis is constant — the distance from the axis for a point moving along the helix.

Grundläggande biokemi Peptider
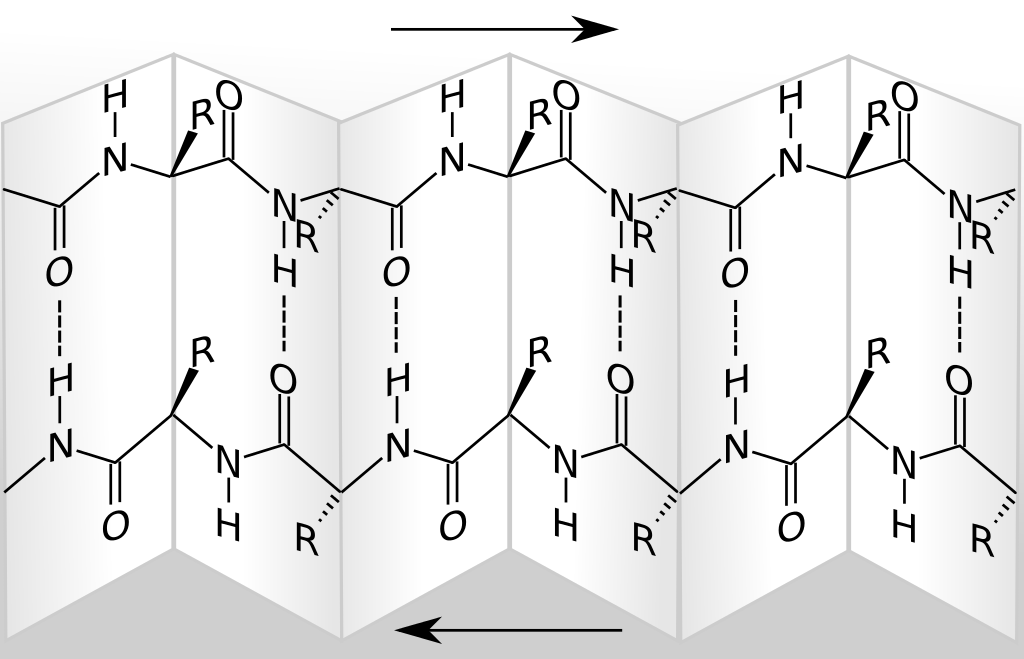
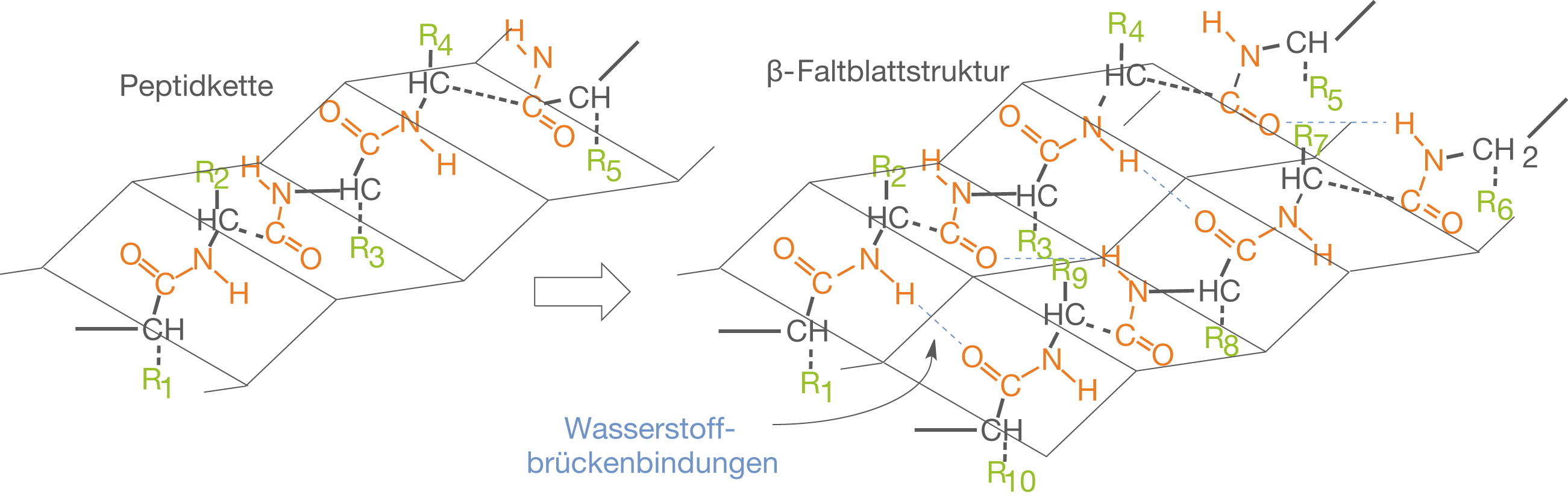
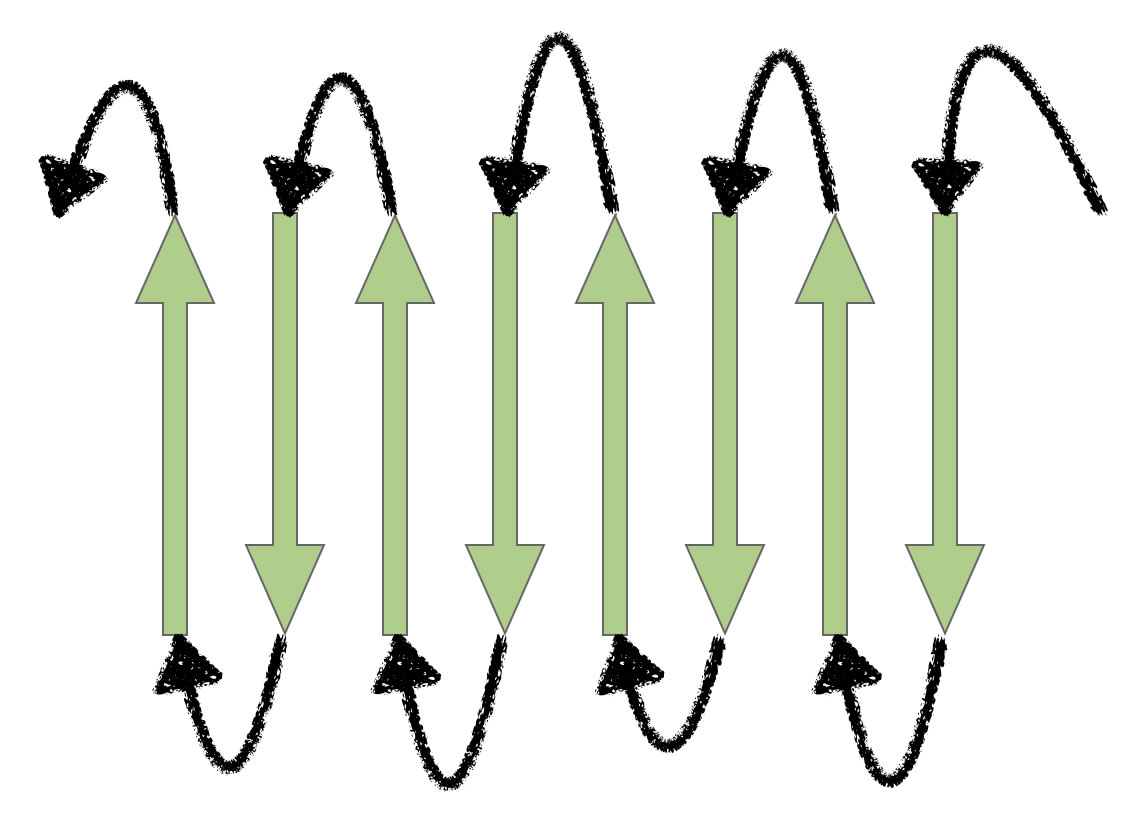
Das β-Faltblatt ist eine Sekundärstruktur von Proteinen, bei der die Polypeptidketten flächenhaft wie eine Ziehharmonika und nicht spindelförmig, wie bei der Alpha-Helix, angeordnet sind. Aufbau Zwei oder mehr Polypeptidketten sind mehr oder weniger parallel angeordnet und durch Wasserstoffbrückenbindung miteinander verbunden.
Naturstoffe Peptide und Proteine (Digitales Schulbuch Chemie)
(01:32) Die Sekundärstruktur ist die relative Anordnung der Einzelbausteine von biologischen Polymeren, wie Nucleinsäuren, Proteinen oder Polysacchariden. Alles Wichtige hierzu erfährst du in diesem Beitrag. Hier geht´s auch direkt zum Video ! Inhaltsübersicht Sekundärstruktur einfach erklärt zur Stelle im Video springen (00:16)
Sekundärstrukturen
1 Geschichte 2 Struktur 2.1 Darstellung 2.2 Andere wichtige Strukturelemente 3 Literatur 4 Siehe auch 5 Einzelnachweise Geschichte Ende der 1930er Jahre begann William Astbury Kristallstrukturanalysen an kristallinen Peptiden durchzuführen.

College. Science. Life Essential Cell Biology 3rd Ch 4 Protein Structure and Function
173 7. 2. use of term alpha and beta for protein-chain-folding is completely unrelated with alpha and beta forms of ring-form monosaccharide. A polypeptide chain can form a spring-shape that is called alpha-helix. A polypeptide can also fold into a flat sheet whose folding pattern is known as beta sheet. - Always Confused.
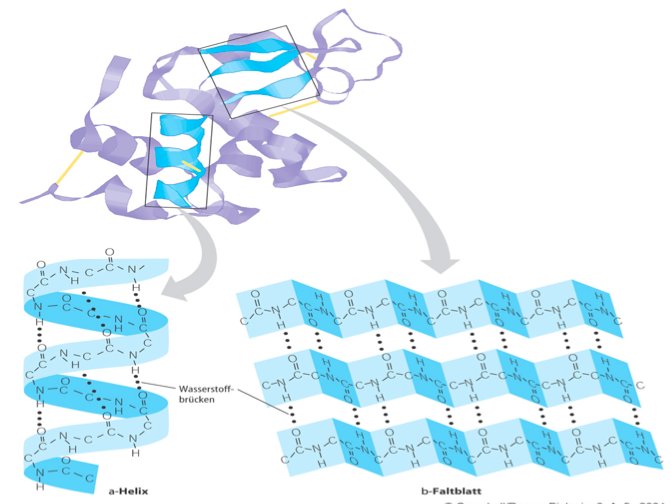
1 α Helix und β Faltblatt Zellbiologie Repetico
PNAS papers by Linus Pauling, Robert Corey, and Herman Branson in the spring of 1951 proposed the α-helix and the β-sheet, now known to form the backbones of tens of thousands of proteins.

Keratin Hair Structure
Abstract. Alpha-helices and beta-sheets are the two most common secondary structure motifs in proteins. Beta-helical structures merge features of the two motifs, containing two or three beta-sheet faces connected by loops or turns in a single protein. Beta-helical structures form the basis of proteins with diverse mechanical functions such as.

Verschil tussen alfahelix en bètageplooide plaat 2022 Nieuws
Durch Hitze brechen diese Bindungen auf und hydrophobe (wassermeidende) Aminosäuren, die sich für Gewöhnlich im Inneren des Proteins befinden, werden freigelegt. 1, 2 Die hydrophoben Aminosäuren versuchen sich von dem Wasser, das sie im Eiweiß umgibt, zu entfernen und binden aneinander.
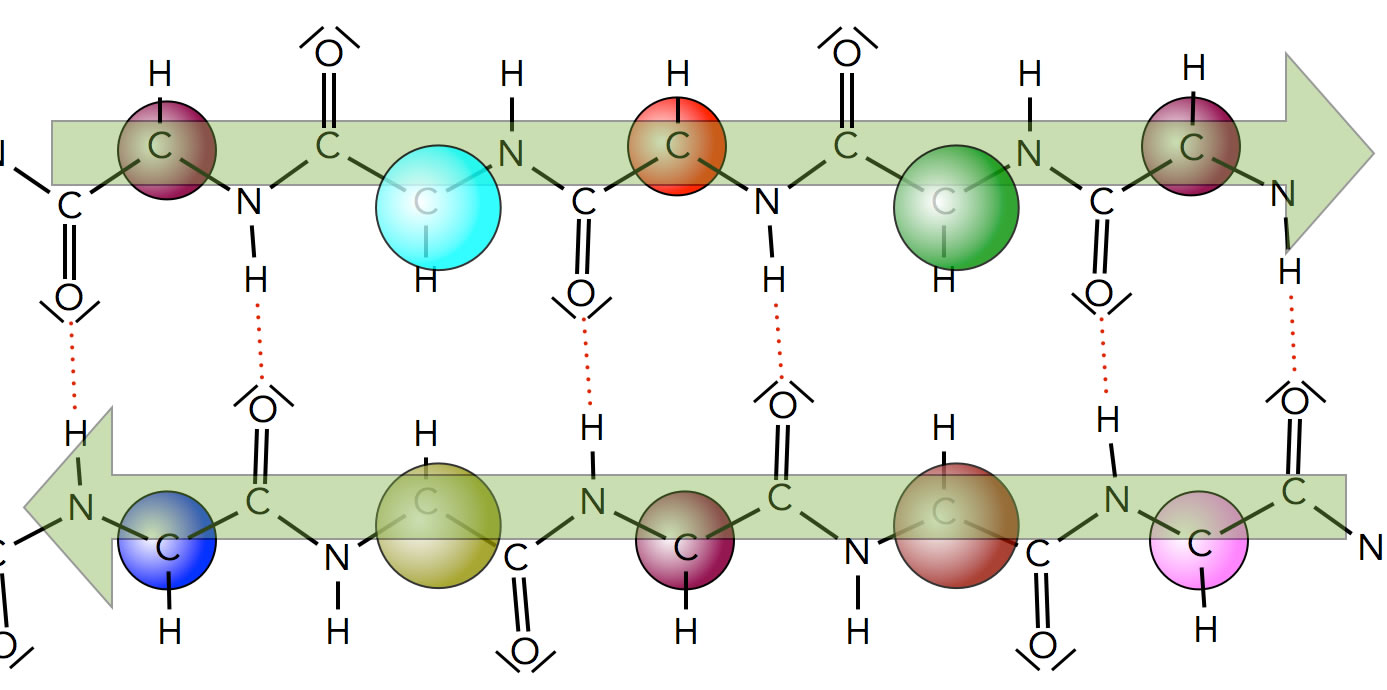
Sekundärstrukturen
These include alpha helices, beta strands (sheets) and reverse turns.. The phi/psi angles for those amino acids in the alpha helix are - 57,-47, which emphasizes the regular repeating nature of the structure. It can also be characterized by n (the number of amino acid units/turn = 3.6) and pitch (the helix rise/turn = 5.4 angstroms)..

1. Secondary structure of protein, αhelix and βpleated sheet [118]. Download Scientific Diagram
Genetik Sekundärstruktur Sekundärstruktur Molekulargenetik Mukoviszidose Mutagene Mutation Nabelschnurpunktion Nukleinbasen Nukleosom Nukleotid Phenylketonurie Phänotyp Polymerase Kettenreaktion Primärstruktur Prophase Proteinbiosynthese Proteine Biologie Proteine Funktion Proteine Lebensmittel Proteinstruktur Biologie Prozessierung

Sekundärstruktur • einfach erklärt, αHelix und βFaltblatt · [mit Video]
An alpha helix (or α-helix) is a sequence of amino acids in a protein that are twisted into a coil (a helix ). The alpha helix is the most common structural arrangement in the secondary structure of proteins.
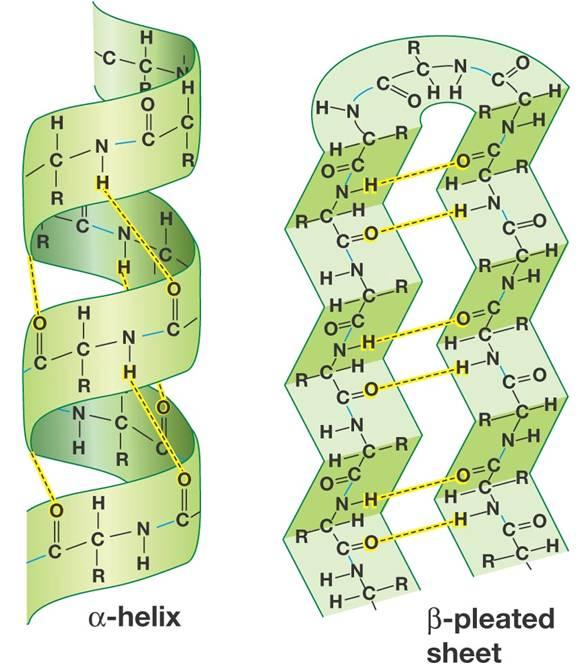
Question 9619f Socratic
α-Selenoid: Das α-Selenoid ist eine Proteinfaltung aus sich wiederholenden α-Helix-Untereinheiten, üblicherweise Helix-Turn-Helix-Motiven, die antiparallel angeordnet sind, um eine Superhelix zu bilden. Ein Beispiel ist die Proteinphosphatase 2A. all-β
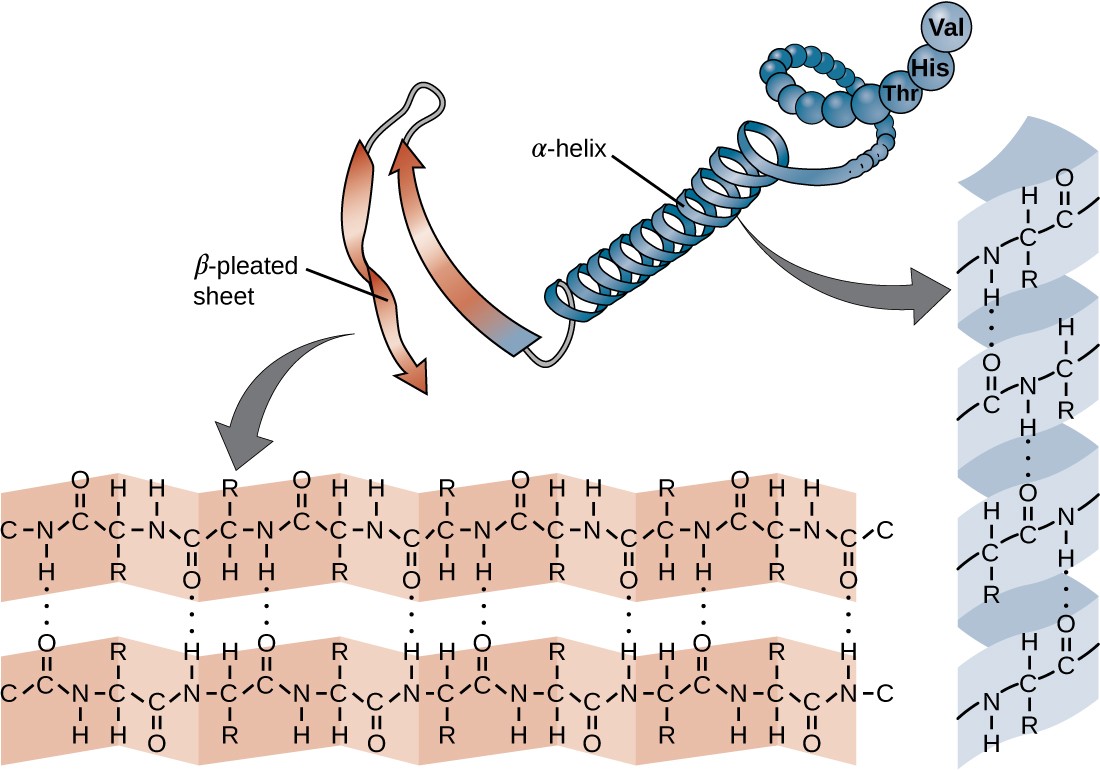
7.4 Proteins Microbiology 201
Secondary Structure: α-Helices Expand/collapse global location